Робота газу. Геометричний зміст роботи в термодинаміці. Внутрішня енергія. Задачі фізики

- Посилання на розділи відеоуроку на тему: Робота газу. Геометричний зміст роботи в термодинаміці. Внутрішня енергія.
- Задачі з фізики: Робота газу під час ізобарного процесу. Геометричний зміст роботи. Внутрішня енергія
- Субтитри до відеоуроку
Посилання на розділи відеоуроку на тему: Робота газу. Геометричний зміст роботи в термодинаміці. Внутрішня енергія.
- 00:00 Урок "Робота в термодинаміці"
- 01:46 Внутрішня енергія при зміна об’єму газу.
- 03:50 Формула для розрахунку роботи газу під час ізобарного процесу: A=p∆V
- 09:57 Роботи газу під час ізотермічного та ізохорного процесів.
- 10:43 Яким є геометричний зміст роботи?
Задачі з фізики: Робота газу під час ізобарного процесу. Геометричний зміст роботи. Внутрішня енергія
- 12:34 Газ, який займав об’єм 0,1 м^3 під тиском 200 кПа, нагріли ізобарно від 290 К до 355 К. Визначити роботу розширення газу.
- 19:06 Молекулярний водень, маса якого 6,5 г і температура 27 °С, нагрівають за сталого тиску так, що його об’єм збільшився вдвічі. Знайдіть роботу, виконану газом під час розширення. Молярна маса водню 2ꞏ10^–3 кг/моль.
- 27:34 Газ переходить зі стану 1 у стан 2 (див. рисунок). Знайдіть роботу, яку виконує газ в ході процесу.
- 34:48 Деяка маса газу, що займає об’єм 11 л, перебуває під тиском 10^5 Па за температури 300 К. Газ нагрівають за постійного об’єму до температури 330 К, а потім за постійного тиску до температури 360 К. Побудуйте графік процесу в координатах р, V. Знайдіть роботу, яку виконав газ в ході процесу.
- 00:12 Розширюючись за постійного тиску, 1 кмоль ідеального газу виконав роботу 831 кДж. Початкові об’єм і температура газу становили 5 м3 і 350 К відповідно. Знайдіть температуру, тиск і об’єм газу в кінцевому стані.
- 11:27 На рисунку наведено графік процесу, що відбувається з 1 моль ідеального газу. Температури газу в станах 1 і 3 збігаються. Знайдіть цю температуру, якщо в результаті процесу газ виконав роботу 10,5 кДж.
- 21:05 Внаслідок ізохоричного охолодження 1 кмоль ідеального газу тиск знизився у 3 рази. Потім газ розширився за постійного тиску. Побудуйте графік процесу, що відбувається, в координатах р, V. Знайдіть роботу, виконану газом, якщо в кінцевому й початковому станах його температура не змінювалася й дорівнює 300 К.
- 36:15 Користуючись графіком, який наведено на рисунку, знайдіть роботу, яку виконує газ під час процесу.


Субтитри до відеоуроку
робота в термодинаміці
проведемо експеримент у товстостінну посудину балон накачаємо повітря через деякий час корок вилітає з посудини спостерігається утворення туману всередині балона під дією яких сил корок вилетів із посудини про що свідчить утворення туману який висновок можна зробити щодо зміни внутрішньої енергії газу який міститься в посудині у момент вильоту Корка в балоні утворився туман це свідчить про те що температура повітря знизилась так як туман є не що інше як водяна пара яка конденсується та навіть кристалізується несподівано потрапивши в область низьких температур Отже внутрішня енергія повітря яка прямо пропорційна температурі зменшилась у результаті того що накачане в балон повітря виконали роботу виштовхнувши корок звідси робимо висновок якщо якесь тіло в нашому випадку газ а саме повітря виконує роботу то його внутрішня енергія зменшується
якщо зовнішні сили стискають газ Тобто його об`єм зменшується це означає що зовнішні сили виконують додатну роботу якщо газ розширяється Тобто його об`єм збільшується це означає що зовнішні сили виконують від`ємну роботу внутрішня енергія газу при цьому може змінюватися це стосовно зовнішніх сил за третім законом Ньютона якщо на газ діє якась зовнішня сила то з боку газу теж діє сила такої ж природи протилежна за напрямком та рівна за модулем тому ми можемо говорити що не лише зовнішні сили але й газ коли стискається або розширяється теж виконує роботу або додатну або від`ємну якщо газ розширяється
він при цьому виконує додатну роботу і віддає енергію навколишньому середовищу як наслідок швидкість руху молекул температура і внутрішня енергія газу зменшується якщо газ стискають
тоді він виконує від`ємну роботу
і не віддає а отримує енергію від навколишнього середовища як наслідок швидкість руху молекул газу температура і внутрішня енергія газу збільшується
робота газу нехай газ розширюється ізобарно
ізобарний процес - це процес змінювання стану даного газу деякої маси що відбувається за незмінного тиску
змоделювати Такий процес не важко якщо газ перебуває під важким поршнем масою m і площею S який може переміщуватися практично без тертя
то в разі збільшення температури фактично підігрівання газу під поршнем об’єм газу буде збільшуватися А тиск газу залишатиметься незмінним
газ діятиме на поршень з деякою силою F і Дана сила виконуватиме механічну роботу механічна робота за означенням це фізична величина яка характеризує зміну механічного стану тіла дорівнює добутку модуля сили F велике на модуль переміщення S і косинус кута альфа між вектором сили та вектором переміщення
тобто А велике дорівнює F на S і на косинус альфа в нашому випадку поршень в результаті розширення газу буде переміщуватися в напрямку дії сили Таким чином кут альфа між вектором сили та напрямком переміщення буде рівний нулю а косинус 0 як відомо рівною одиниці
переміщення S буде Рівне різниці L2
положення поршня після розширення газу мінус е людини положення поршня до розширення ізобарного цю різницю можна позначити Дельта L
якщо газ розширюється ізобарно
тобто за незмінного тиску то сила яка діє з боку газу на поршень є незмінною
за означенням тиск це фізична величина яка характеризує результат дії сили і дорівнює відношенню сили F яка діє перпендикулярно до поверхні до площі цієї поверхні S
з цієї формули можна виразити силу через тиск зробимо Це Таким чином F сила яка діє з боку газу на поршень буде рівно добутку тиску який у нас незмінний на S велике площу нашого поршня
підставимо отримані значення в формулу для обчислення роботи Таким чином ми матимемо F тиск на площу поршня помножити на 2 -1 або P помножити на S помножити на 2S помножити на L1 добуток площі поршня на L2 та площі поршня на L1 це буде нещо інше як об`єм газу який він буде займати
до розширення s*1 і після розширення S помножити на L2 іншими словами робота буде рівна P помножити на V2 - V1 де V2 кінцевий об`єм газу ав1 початковий об`єм газу до ізобарного розширення або якщо скорочено p * v Дельта в зміна об`єму газу
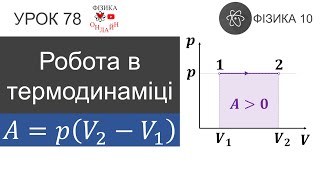
зобразимо в координатах PV тиск об`єм так звану ізобару тобто графік ізобарного процесу співставивши графік і формулу для розрахунку роботи газу ми бачимо що робота газу в разі ізобарного розширення
чисельно дорівнює площі прямокутника під графіком залежності
тиску P від об`єму газу в
Аналогічно робота газу
в разі ізобарного стиснення
теж чисельно дорівнює площі прямокутника під графіком залежності тиску від об`єму газу
робота газу при ізотермічному розширенні або стиснення тобто за незмінної температури чисельно дорівнює площі криволінійної трапеції
під графіком залежності P від V
при ізохорному процесі за незмінного об`єму газ роботу не виконує і відповідно площа під графіком залежності тиску від об`єму теж рівна нулю
узагальнюючи вищесказане можна стверджувати що робота газу при довільному процесі дорівнює площі фігури під графіком залежності тиску від об`єму як наслідок робота газу залежить від того яким шляхом відбувався перехід газу з початкового стану 1 в кінцевий 2
нехай ми маємо три шляхи переходу газу зі стану один у стан 2
перший газ ізобарно розширяється потім ізохорного охолоджується
другий газ ізотермічно розширяється
та третій газ ізохорно охолоджується потім ізобарно розширяється
площі фігур під графіками показують
що робота в першому випадку буде більше за роботу в другому
і ця робота в свою чергу буде більше за роботу в третьому випадку
розв’язування задач задача 1 газ який займав об`єм 0,1 м кубічного під тиском 200 кПа нагріли ізобарно від 290 кельвінів до 350 кельвінів визначити роботу розширення газу
розв`язок
запишемо дано газ який займає об`єм V1 великі 0,1 метра кубічного під тиском p200 кілопаскаль або 2*10^5 Паскаль якщо врахувати що префікс кіло означає 10³ нагріли ізобарно від температури Т1 початкової 290 градусів Кельвіна до кінцевої температури Т2 355 градусів Кельвіна визначити роботу а
ізобарного розширення газу
ізобарний процес - це процес змінювання стану даного газу деякої маси що відбувається за незмінного тиску P = Констант змоделювати ізобарний процес можна наступним чином якщо газ перебуває
під важким поршнем деякою маси м
і площею S який може переміщуватися практично без тертя то в разі збільшення температури фактично шляхом підігрівання газу під поршнем об`єм газу буде збільшуватися А тиск газу при цьому залишатиметься незмінним і визначати і визначатиметься сумою атмосферного тиску плюс тиск який чинитиме поршень деякою маси своєю вагою
робота при ізобарному розширенні
визначається по формулі А дорівнює P тиск газу помножити на
зміну його об`єму V2 -v1
ізобарний процес як ми вже сказали це процес за незмінного тиску скористаємося цією формулою для розв`язку нашої задачі
для того щоб розрахувати роботу нам не вистачає об`єму газу за температури Т2 355 градусів Кельвіна для того щоб її визначити Нам доведеться пригадати що ізобарний процес описується законом гейлюсака
який говорить наступне для даного газу деякої маси відношення об`єму газу в до температури те є незмінним якщо тиск газу не змінюється тобто P дорівнює констант іншими словами Якщо у нас об`єм газу і температура в стані 1 рівні v1т1 а в результаті ізобарного розширення об`єм став рівний V2 температура Т2 то виконується наступна рівність ви один поділити на t1=2 поділити на Т2 використаємо цей закон для того щоб знайти об`єм V2 газу після ізобарного нагрівання
з цього закону V2 буде Рівне V1 помножити на Т2 і поділити на Т1 підставимо значення об`єму формулу для розрахунку роботи газу отримаємо що після того як ми винесемо V1 за дужки робота буде обчислюватися по формулі а = pv1 помножити в дужках Т2 поділити на T1 -1
перевіряємо одиниці вимірювання тиск вимірюється в паскалях об`єм в метрах кубічних температура в кельвінах одиниця безрозмірна Паскалі за означенням - це відношення сили до площі можемо записати що це буде ньютони поділити на метри квадратні кулон кельвіни у нас скоротилися в результаті в нас скоротяться метри квадратні залишаться лишень ньютони помножені на метри тобто сила на переміщення зрештою це є одиниця
вимірювання роботи тобто джоуль Таким чином робота газу вимірюється в джоулях що є правильним рахуємо числове значення а = тиск
2*10^5 Паскаль помножити на початковий об`єм газу 0,1 м кубічних помножити в дужках Т2 355 кельвінів поділити на 290 кельвінів і -1 Провівши обчислення наближено матимемо що робота буде рівна 4,5 на 10³ Дж 10³ можна замінити префіксом кіло звідси робота буде рівна 4,5 кДж
задача 2 молекулярний водень маса якого 6,5 г і температура 27 градусів Цельсія нагрівають за сталого тиску так що його об`єм збільшився вдвічі знайдіть роботу виконану газом під час розширення молярна маса водню дорівнює 2 на 10 у мінус третій степені кілограм на моль розв`язок
запишемо дано молекулярний водень маса якого м маленьке дорівнює 6,5 г в одному грамі 10 - 3 степені кілограм і температура якого Т1 рівно 27 градусів Цельсія або 300 градусів Кельвіна нагрівають за сталого тиску так що його об`єм збільшився вдвічі якщо ми позначимо об`єм молекулярного водню за температури 27 градусів Цельсія V1 то після нагрівання засталого тиску його об`єм V2 буде рівний двом об`ємом V1 іншими словами V2 буде Рівне 2в1 знайдіть роботу виконану газом під час розширення позначається А велике якщо молярна маса водню м велика дорівнює 2 * 10 - третій степені кілограм на моль
нагрівання за сталого тиску означає що ми маємо справу з ізобарним процесом ізобарний процес - це процес змінювання стану даного газу в нашому випадку молекулярного водню деякої маси в нашому випадку 6,5 г що відбувається за незмінного тиску тобто при п = Констант інформації про тиску у нас немає робота газу в разі ізобарного розширення обчислюється по формулі P тиск газу помножити на V2 - V1 де V2 це об`єм газу після ізобарного розширення ав1 об`єм газу до розширення
скористаємося даною формулою для розв`язку нашої задачі Таким чином робота буде рівна якщо ми розкриємо дужки pv2 - пв1 нам залишається невідомий тиск але при цьому Ми маємо деяку інформацію про температуру
це означає що нам необхідно скористатися рівнянням стану ідеального газу або так званим рівнянням менделєєва-клапейрона рівняння стану ідеального газу пов`язує між собою макроскопічні параметри які характеризують деякі об`єм газу м тиск об`єм та температуру ми можемо це рівняння застосувати для молекулярного водню
таким чином замість добутку тиску на об`єм P помножити на V2 та P помножити на V1 ми можемо записати що pv2 буде Рівне м маса газу поділити на його молярну масу помножити на R універсальну газу стали помножити на Т2 температура газу після нагрівання мінус M поділити на молярну масу R помножити на T1 винісши за дужки м поділити на молярну масу помножити на R отримаємо в дужках Т2 -1 зміну температури нашого молекулярного водню в даному співвідношенні для того щоб обчислити виконану роботу нам не вистачає значення температури до якої був нагрітий наш молекулярний водень для того щоб її визначити доведеться пригадати що ізобарний процес дуже добре описується законом гей-люсака
цей закон говорить наступне для даного газу деякої маси відношення об`єму газу в до температури те є незмінним якщо тиск газу не змінюється іншими словами якщо газ з стану який характеризується температурою Т1 та об`єму V1 перевести в стан який характеризується температурою Т2 та об`ємом V2 до прикладу ізобарно розширити буде виконуватися буде виконуватися рівність V1 поділити на t1=2 поділити на Т2 скористаємося даним законом гелю сака для розв`язку нашої задачі
з цієї рівності ми можемо визначити Т2 температуру після нагрівання газу за сталого тиску вона буде рівна T1 помножити на V2 поділити на V1 після цього замість V2 підставимо значення 2в1 в результаті V1 у нас скорочується і ми отримаємо що температура молекулярного водню Т2 буде рівно два помножити на T1 тобто температура зросла вдвічі
підставимо це значення температури Т2 формулу для розрахунку роботи газу при ізобарному розширенні
матимемо що
маса молекулярного водню поділити на молярну масу помножити на R універсальну газову сталу в дужках замість Т2 2т1 мінус T1 2 Т1 -1 дасть просто Т1
перевіряємо одиниці вимірювання маса газу вимірюється в кілограмах молярна маса в кілограмах на моль універсальна газова стала вимірюється в джоулях поділити на моль помножити на Кельвін і температура Т1 вимірюється в кельвінах в результаті в нас скоротяться Молі кілограми таке він не залишиться лише Джоулі робота вимірюється в джоулях що є правильним рахуєм числове значення а дорівнює маса молекулярного водню 6,5 на 10 - 3 степені кілограм поділити на молярну масу 2 на 10 в мінус третій кілограм на моль помножити на 8,31 Дж поділити на моль помножити на Кельвін і помножити на Т1 температуру 300 кельвінів Провівши обчислення матимемо що зрештою робота виконана газом під час розширення буде приблизно рівно 8 100
812 Дж або наближено 8,1 кДж
задача 3 газ переходить зі стану 1
у стан 2 знайдіть роботу яку виконує газ в ході процесу розв`язок
Отже газ переходить стану 1 в стан 2
необхідно знайти роботу яку виконує газ в ході даного процесу
робота газу при довільному процесі дорівнює площі фігури під графіком залежності тиску P від об`єму V даного газу
в нашому випадку виходячи з цього твердження робота газу буде рівна площа ось цієї фігури
дана фігура геометрична називається трапецією хто не впізнав тут трапецію давайте повернемо цей графік на 90 градусів Таким чином ми отримаємо геометричну фігуру яка уже нам дійсно схожа на трапецію
трапеція - це чотирикутник дві протилежні сторони якого паралельні як у нашому випадку а інші дві сторони не паралельні
паралельні сторони називають основою трапеції
інші сторони називають бічними сторонами
виділяють два класи трапеції рівнобічна трапеція тобто трапеція у якої бічні сторони рівні та прямокутна трапеція це трапеція у якої два кути прямі саме така зображена на малюнку і саме з такою трапецією ми маємо справу і в нашому випадку відстань H між основами трапеції називається висотою трапеції площа трапеції
обчислюється як півсума основ помножена на висоту трапеції в нашому випадку площа
яка нас цікавить яка чисельно дорівнює роботі нашого газу в даному процесі відповідно буде рівна
перша основа яка буде дорівнювати тиску газу P1 + 2 основа тиск газу P2
поділити на 2 і помножити на висоту трапеції висотою трапеції у нас є різниця об`ємів V2 мінус V1 і це буде у нас висота нашої трапеції Таким чином робота газу отримана на основі графіка залежності P від в буде дорівнювати P1 + Р2 поділити на 2 помножити на V2 - В1 нам залишилося визначити значення для p1p2 V1 V2 з нашого графіка
P1 тобто тиск в стані 1 буде дорівнювати згідно графіка треба бути уважним двом атмосферам атмосфера - це позасистемна одиниця для того щоб перевести тиск в систему сі тобто в Паскалі необхідно значення в атмосферах домножити на 10^5 Таким чином тиск P1 у нас буде рівний 2*10^5 Паскаль об`єм V1 при цьому буде рівний 1 м³ в стані два тиск P2 буде рівний 4 на 10 в 5 степені паскаль а об`єм газовий 2 буде дорівнювати 4 метри кубічних зафіксуємо ці дані
можемо переходити до обчислень перевіряємо одиниці вимірювання
робота яку виконує газ в ході процесу переходячи з стану один в стан 2 буде відповідно обчислюватися в наступних одиницях P1 + P2 дасть нам Паскалі V2 - V1 дасть нам метри кубічні 2 у нас безрозмірне один Паскаль це одиниця тиску яка визначається по формулі як сила поділено на площу тобто ньютони на метри квадратні в результаті метри квадратні скорочуються у нас залишиться ньютони помноженні на метри тобто сила на переміщення добуток сили на переміщення дасть нам роботу тобто Джоулі Таким чином робота газу вимірюється в джоулях що є правильним рахуєм числове значення а велике дорівнює P1 2 на 105 степені Паскаль додати п2 4 * 10 в степені Паскаль помножити V2 4 м³ - V1 1 м³ і це все ділимо на 2 Провівши обчислення матимемо що
даний вираз буде рівний 9 помножити на 10 в 5 степені Джоуля врахувавши що 10³ можна замінити префіксом кіло отримаємо що з рештою роботою яку виконує газ в коді описаного процесу рівна 900 кДж
задача 4
деяка маса газу що займає об`єм 11 літрів перебуває під тиском 10 в 5 степені Паскаль за температури 300 кельвінів газ нагрівають за постійного об`єму до температури 330 кельвінів а потім за постійного тиску до температури 360 кельвінів побудуйте графік процесу в координатах PV тобто залежності тиску від об`єму Та знайдіть роботу яку виконав газ в ході процесу розв`язок
запишемо дану деяка маса газу що займає початковий об`єм V1 великі 11 літрів 1 л 10 - 3 степені метри кубічного перебуває під тиском В1 105 степені Паскаль і за температури Т1 300 кельвінів Тобто ми маємо деякий газ який знаходиться в початковому стані що характеризується об`ємом тиском та температурою потім газ нагрівають за постійного об`єму до температури 330 кельвінів
позначимо температуру до якої нагрівся ГАЗ Т2 великі це буде означати що газ перевели з стану 1 в стан 2
в цьому стані два він характеризується температурою Т2 330 кельвінів та деяким значенням об`єму і тиску V2 і Р2 потім уже за постійного тиску від температури 330 градусів Кельвіна його знову нагріли уже до температури 360 градусів Кельвіна і Він опинився в деякому стані 3 з температурою Т3 об`ємом V2 та об`єму V3 та тиском пе-3 необхідно побудувати графік процесу в координатах PV та знайти роботу а яку виконав газ в ході цього процесу якщо ми зможемо побудувати графік процесу в координатах PV то відповідно зможемо і обчислити роботу газу тому що робота газу при довільному процесі дорівнює площі фігури під графіком залежності P від в нашого процесу Але для того щоб побудувати цей графік нам треба нанести в координатах P від P основні стани
тобто початковий кінцевий як в нашому випадку і деякий проміжний стан
в якому опинявся газ в результаті його нагрівання
щоб нанести ці ключові стани в координатах ПВ Нам необхідно знати для кожного станів значення тиску та об`єму
для першого стану початкового значення V1 та P1 ми знаємо
Окрім цього ми знаємо що Газ спочатку нагрівають за постійного об`єму до температури 330 кельвінів за постійного об`єму означає що ми маємо справу з ізохорним процесом ізохорний процес - це процес змінювання стану даного газу деякої маси що відбувається замінного об`єму тобто за умови V дорівнює Констант
Таким чином при ізохорному процесі при переході стану 1 стан 2 у нас кінцевий об`єм V2 буде рівний початковому V1 і буде зрештою дорівнювати 11 на 10 у мінус третій степені метри кубічному нам залишається з`ясувати значення P2 тобто тиск газу в стані 2
для цього Нам необхідно пригадати закон Шарля закон Шарля описує ізохорний процес і звучить він наступним чином для даного газу деякої маси відношення тиску газу P до його температури є незмінним якщо об`єм газу не змінюється іншими словами якщо об`єм газу не змінюється і в деякому стані один газу він характеризується тиском P1 та T1 а в деякому стані два тиском п2 і Т2 за незмінного об`єму то тоді виконується рівність p1/1 = Р2 поділити на Т2 запишемо даний закон Шарля для наших станів
з цієї пропорції P2 буде Рівне P1 помножити на Т2 і поділити на Т1
підставляємо значення P2 буде дорівнювати P1 10 в 5 степені Паскаль помножити на Т2 335 кельвінів поділити на T1 300 кельвінів І це буде дорівнювати 1,1 на 10 в 5 степені Паскаль Таким чином другий стан який ми маємо нанести в координатах PV нам уже відомий наступним кроком було Над подальші нагрівання газу з стану P2 V2 до стану п3 V3 за постійного тиску до температури 360 кельвінів
Отже наш газ переходить з стану 2 з значеннями тиску P2 об`єму V2 та температури Т2 стан 3 за постійного тиску з температурою 360 кельвінів процес за постійного тиску називається ізобарним ізобарний процес це процес змінювання стану даного газу деякої маси що відбувається за незмінного тиску тобто за умови P = Constant так як наш перехід стану в два стан 3 є ізобарним ми можемо записати що тиск п3 буде дорівнювати P2 і відповідно так як ми вже значення по два знаємо 1,1 на 10^5 Паскаль нам залишається з`ясувати яким став об`єм газу В3
ізобарний процес описується законом гей-люссака цей закон говорить що для даного газу деякої маси відношення об`єму газу до температури є незмінним Якщо тиск газу не змінюється іншими словами якщо в деякому стані 1 газ характеризується об`ємом V1 та температурою Т1 а в стані два об`ємом V2 та температурою Т2 і при цьому в обох цих станах тиск не змінювався тоді виконується рівність V1 поділити на t1=2 поділити на 2 запишемо дану рівність для станів 2 та 3 які є частиною ізобарного процесу
з цієї рівності V3 буде Рівне V2 помножити на Т3 поділити на Т2 підставимо значення ви3 буде дорівнювати V2 об`єм який ми уже обчислили 11 на 10 у мінус третій степені метра кубічного помножити на Т3 360 к лінію поділити на Т2 330 кельвінів Провівши обчислення матимемо що
V3 буде Рівне 12 на 10 у мінус третьому степені метри кубічному Таким чином третій стан у нас характеризується значеннями тиску та об`єму можемо перейти до побудови графіка
Отже ми знаємо макроскопічні параметри станів один
два та три і можемо зобразити їх в координатах PV
стан 1 характеризується об`ємом V1
11 на 10 у мінус третьому метри кубічному та тиском P1 10 в 5 степені Паскаль Для зручності для того щоб не відкладати по осях числові значення з множником 10 в якісь степені можемо зробити наступне наприклад об`єм відкладемо в літрах замінивши 10 у мінус третій метра кубічного на літри А тиск замість того щоб писати 10 в 5 степені можемо перевести як значення в кілопаскалях відповідно значення P1 105 степені буде Рівне 100 помножити на 10³ Паскаль або 100 кПа це відразу спростить нам значення яке ми візуально відкладаємо по осях P і в мова йде про числові значення стан 2 характеризується об`ємом V2 11 літрів та тиском 110 кПа стан 3 характеризується об`ємом 12 літрів та знову ж таки 110 кПа
наступним кроком зобразимо спочатку ізохору ізохорний процес
а потім ізобару у вигляді прямих ліній і вкажемо стрілкою напрямок процесу що це було саме ізохорне нагрівання а потім ізобарне нагрівання стрілка в зворотньому напрямку буде означати що спочатку було ізобарне охолодження а потім ізохорною охолодження що буде неправильно
робота газу
при довільному процесі дорівнює площі фігури під графіком залежності P від V в нашому випадку
робота
газу буде дорівнювати сумі робіт
в ході процесу 1-2
та робіт або роботи в ході процесу 2-3
робота в ході процесу 1-2 А це процес за постійного об`єму ізохорний процес чисельно дорівнює нулю
робота в ході процесу 2-3 чисельну дорівнює площі прямокутника під цією ізобарою
причому варто зауважити що мова йде про прямокутник який не закінчується на усі яка зображена на малюнку насправді це прямокутник який
має протяжність аж до значення P яке Рівне нулю і Яке Просто не поміщається в нас На графіку Таким чином робота в газу в ході процесу 2-3 буде чисельно рівна площі прямокутника зі сторонами P2 або Петри що одне й теж саме та різницею об`ємів ; в 3 - V2
отже в результаті цього робота буде рівна
загальна в результаті процесу роботі на ділянці 2-3
перевіряємо одиниці вимірювання
P2 Паскалі різниця об`ємів метри кубічні Паскалі можемо розписати як тиск який означений як відношення сили до площі тобто ньютони на метри квадратні метри квадратні скорочуються залишаються ньютоні на метри Ньютон на метр - це сила на переміщення що дає нам роботу тобто Джоулі Таким чином робота газу вимірюється в джоулях що є правильним підставляємо числові значення а = P2
1,1 на 10.5 помножити на V3 12 на 10 - 3 м³ - V2 11 на 10 -3 м³ і це буде дорівнювати 110 дж
спробуйте дати відповіді на наступні запитання перше Яким є геометричний зміст роботи
друге виведіть формулу для розрахунку Роботи під час ізобарного процесу
третє чому дорівнює робота під час ізохорного процесу
домашнє завдання опрацювати параграф 37 вправа номер 37 пункти 2 та 4
урок 79-й розв`язування задач за темою робота в термодинаміці
задача один розширюючись за постійного тиску 1 к моль ідеального газу виконав роботу 831 кДж початкові об`єм і температура газу встановили 5 метрів кубічних і 350 кельвінів відповідно знайдіть температуру тиск і об`єм газу в кінцевому стані розв`язок
запишемо дано розширюючись за постійного тиску 1 к моль ідеального газу в моль вимірюють кількість речовини яка позначається маленькою літерою префікс кіло означає 10³ 1 к моль ідеального газу виконав роботу а велике 831 кДж врахувавши що префікс кіл означає 10³ а 831 можна подати як добуток 8,31 на 10² зрештою матимемо 8,31 на 10 в п`ятій степені Джоуля початкові об`єм і температура газу тобто V1 та Т1 становили 5 метрів кубічних і 350 кельвінів відповідно знайдіть температуру тиск і об`єм газу в кінцевому стані тобто в стані два позначимо температуру Т2 тиск P2 а об`єм V2
так як згідно умови задачі ми маємо випадок розширення ідеального газу за постійного тиску це означає що ми маємо справу з ізобарним процесом ізобарний процес - це процес змінювання стану даного газу деякої маси що відбувається за незмінного тиску
при ізобарному розширенні робота газу
А велике дорівнює добутку P тиску газу який не міняється рівний констант на різницю об`ємів V2 - V1 де V2 об`єм газу в кінцевому стані А ви один об`єм газу в початковому стані
використаємо дану формулу для розв`язку нашої задачі Отже робота газу при ізобарному розширенні а буде рівна якщо ми розкриємо дужки P помножити на V2 - р помножити на V1 в цій рівності У нас дві невідомих величини нам невідомий тиск Та нам невідомий об`єм газу в кінцевому стані V2 спробуємо виразити добуток PV через температуру і позбутися однієї невідомої величини
так як для будь-якого з станів ми можемо записати рівняння стану ідеального газу яке виглядає наступним чином p * v = M маленьке поділити на м великі де М великі молярна маса ам маленьке це маса нашого газу помножити на РТ де R універсальна газова стала відношення маси газу до м велике до маси одного моль цього газу дасть нам кількість моль газу таким чином рівняння стану ідеального газу порівняння менделєєва-клапейрона запиши цю у вигляді ПВ = New RT записавши це рівняння для початкового і кінцевого стану ми виразимо добуток тиску на об`єм через температуру
і наша робота та Таким чином буде виражена через температуру а не через добуток тиску на об`єм тобто New R t21
день ю кількість моль ідеального газу винесемо New R за дужки отримаємо в дужках Т2 -1 від кінцевої температури відняти початкову в даній рівності так як робота нам числове значення її відоме нам залишається невідомою Т2 температура в кінцевому стані вона буде дорівнювати а поділити на Нью R плюс T1 перевіряємо одиницю вимірювання робота вимірюється бджолях кількість речовини Нью в молях універсальна газова стала дорівнює 8,37 і вимірюється в джоулях поділити на моль помножити на Кельвін плюс температура T1 вимірюється в кельвінах Джоулі Джоулі Молі Молі скорочуються кельвіни ідуть в чисельник кельвіни + кельвіни дощ нам просто кельвіни тобто температура газу в кінцевому стані вимірюється в кельвинах що є правильним підставляємо числове значення Т2 = робота 8,31 на 105 степені Джоуля поділити на Нью 10³ моль помножити на R 8,31 джоуль поділити на моль помножити на Кельвін і додати початкову температуру нашого ідеального газу Т1 350 кельвінів привівши обчислення ми знайдемо що кінцева Температура буде рівна 450 кельвінів тобто перше значення Т2 Ми уже знайшли
отже як ми вже казали розширення за постійного тиску газу називається ізобарним процесом ізобарний процес описується законом гей-люсака який говорить наступне для даного газу
деякої маси відношення об`єму газу в до температури те є величиною незмінною Якщо тиск газу не змінюється тобто P дорівнює констант іншими словами якщо в деякому стані початковому наш ідеальний газ займає об`єм V1 при температурі Т1 то
розширяючись
ізобарно він переходить в стан з деякою температурою Т2 і об`ємом V2 в результаті відношення V1 до T1 буде дорівнювати відношенню в два до Т2 використаємо даний закон для того щоб знайти кінцевий об`єм нашого газу тобто об`єм газу в кінцевому стані Отже згідно закону гелю сака V1 поділити на один на t1=2 поділити на C2 звідси V2 = по діагоналі V1 множимо на Т2 і ділимо на все що залишилося тобто на T1 V2 = V1 * T2 / T1 можемо переходити до обчислень перевіряємо одиниці вимірювання температура вимірюється в кельменів і відразу в кельвінах і відразу скорочується в нас залишається метри кубічні тобто об`єм газу ідеального В кінцевому стані вимірюється в метрах кубічних що є правильним підставляємо числові значення В2 = V1 5 м³ * відношення температур Т2 яке Ми щойно розрахували 450 кельвінів поділити на T1 350 кельвінів пробівши обрахунки матимемо що об`єм газу в кінцевому стані наближено дорівнює 6,43 м³
Отже нам залишилося знайти тиск газу п-2 в кінцевому стані на початку ми говорили що робота газу в разі ізобарного розширення дорівнює добутку тиску P на різницю об`ємів ви два мінус V1 причому ми виражали тиск і об`єм через температуру тому що в нас було надто багато невідомих величин тепер ми можемо повернутися до даного співвідношення так як у нас відомими є і V2 і V1 і з даного співвідношення знайти P тобто тиск газу при ізобарному розширенні отже
робота буде рівна P помножити на різницю об`ємів в кінці підняти об`єм на початку звідси P тиск буде рівний а поділити на V2 V1 перевіряємо одиницю вимірювання робота вимірюється в джоулях об`єми це буде різниця метрів кубічних Джоулі робота розписується як сила на переміщення тобто ньютони помножені на метри звідси одні метри скоротяться залишиться ньютони поділені на метри квадратні відношення сили до площі це і є тиск який вимірюється в паскалях підставляємо числові значення P = робота 8 31 на 10 у п`ятій степені Паскаль поділити на різницю об`ємів щойно обраховано нами 6,43 м³ - 5 метрів кубічних обчисливши матимемо що тиск ідеального газу в кінцевому стані буде дорівнювати 5,8 на 10 в 5 степені Паскаль або замінивши 10 в шостій степені префіксом мега матимемо що об`єм буде рівний 0,58 МПа
задача 2 на рисунку наведено графік процесу що відбувається з одним моль ідеального газу температура газу в станах один та три збігаються знайдіть цю температуру якщо в результаті процесу газ виконав роботу 10,5 кДж
розв`язок
запишемо дано на рисунку наведено графік процесу що відбувається з одним моль ідеального газу в моль визначають кількість речовини вона позначається маленькою літерою температура газу в станах 1 та 3
збігається іншими словами в станах один та три температура та один дорівнює Т3 знайдіть цю температуру якщо в результаті процесу один три газ виконав роботу а великі 10,5 кДж префікс кіло означає 10³ Джоуля
робота газу під час процесу один три один два три один три
буде дорівнювати сумі робіт на ділянці 1-2 А 1-2 плюс сум плюс робота на ділянці 2-3
тобто А дорівнює а1-2+13
Причому на ділянці 2-3 ми маємо справу з процесом в якому є незмінним об`єм
цей об`єм в станах два і три він є однаковим і дорівнює чотирьом об`ємом в стані 1 тобто V1 Цю умову можемо записати як v2=3 і дорівнює 4 В1
виходячи з цього можемо зробити висновок що на ділянці 2-3 ми маємо справу з так званим ізохорним процесом під час ізохорного процесу газ роботи не виконує тобто робота на даній ділянці буде рівно нулю тому відразу так і Запишемо що а23=0 таким чином робота газу загальна буде визначатися роботою на ділянці а1-2 на ділянці а1-2 ми маємо справу з процесом в якому залишається незмінним тиск тобто P1 = P2 і дорівнює на прикладі якомусь значенню P процес під час якого тиск залишається незмінним називається і зубарним процесом
згідно нашого малюнка в стані два який передував стану 1 об`єм буде більший Тобто ми маємо справу з ізобарним розширенням газу при ізобарному розширенні робота обчислюється по формулі P тиск нашого газу а він буде однаковий і в стані 1 і в стані два тобто тут може бути як пе один так і P2 помножити на різницю об`ємів скористаємося даною формулою і Запишемо що в даному випадку робота буде рівна P1 помножити на V2 - V1
так як згідно умови задачі нам Необхідно розрахувати температуру
тому скористаємося рівнянням стану ідеального газу для того щоб перейти від добутку тиску на об`єм до температури рівняння стану ідеального газу можна записати для будь-якого стані в ідеального газу який характеризується тиском б об`ємом в та температурою т в даному рівнянні відношення маси газу до його маси одного моля називається кількістю речовини позначається літерою вона у нас відома таким чином
Формула рівняння Менделєєва Клапейрона ПВ = нюрц дозволить нам перейти від макроскопічних параметрів тиск об`єм до температури газу
в цьому випадку робота а буде рівна New R помножити на Т2 - Т1
Отже формулі для розрахунку роботи газу у нас є дві невідомих величини Т2 та Т1 спробуємо виразити температуру в стані два та два Через температуру в стані 1 врахувавши що ми маємо справу на ділянці 1-2 ізобарним процесом який описується законом гей-люсака згідно законусака для даного газу деякої маси відношення об`єму газу в до температури те є незмінним якщо газ тиск газу як у нашому випадку не змінюється іншими словами якщо в якомусь стані один газ схарактеризується об`ємом В1 та Т1 а в стані два об`ємом V2 і Т2 і це той самий газ то між відношеннями V1 поділити на T1 та V2 поділити на C2 можна поставити знак рівності з цієї формули можемо виразити значення температури Т2 через температуру Т1 що ми зараз і зробимо отже за законом гейллюсака Т2 у нас буде Рівне Т1 помножити на V2 поділити на V1 підставиш замість V2 4 V1 ми матимемо що Т2 температура в стані 2 виявиться в 4 рази вищу ніж в стані Т1 ніж в стані 1 і в чотири рази вищу ніж в стані 3 тому що Т1 дорівнює Т3 підставимо це значення для Т2 формулу для розрахунку роботи а буде дорівнювати New R помножити на Т2 - Т 1 тобто робота на ділянці 1-2 де замість Т2 можна підставити 4 Т3 або 4т1 в нашому випадку ми підставимо зрозуміло 4 Т1 і зрештою будемо мати що робота буде рівна тринью R помножити на T1
знаючи роботу числове значення знаючи кількість моль нашої ідеального газу new
а також універсальну газову сталу р можемо легко розрахувати температуру в стані 1 і відповідно в стані 3
вона буде рівна
а поділити на 3 Нью R перевіряємо одиницю вимірювання робота вимірюється в джоулях
три безрозмірне кількість речовини New поміряється у молях універсальна газова стала 8.31 Дж поділити на моль помножений на Кельвін Джоулі Молі скорочуються кельміни ідуть в чисельник Таким чином температура Т1 і відповідно Т3 вимірюється в кельвінах що є правильним рахунком числове значення Т1 буде дорівнювати робота 10,5 10/3 степені Джоуля поділити на 3 помножити на 1 моль і помножити на R 8,31 джоуль поділити на моль помножити на Кельвін обчисливши значення матимемо що температура ідеального газу в станах 1-3 буде приблизно рівно 421 Кельвін
задача 3 внаслідок ізохоричного охолодження одного кіло моль ідеального газу тиск знизився у три рази потім газ розширився за постійного тиску побудуйте графік процесу що відбувається в координатах PV тиск об`єму знайдіть роботу виконану газом якщо в кінцевому і початковому станах його температура не змінювалася й дорівнює 300 кельвінів розв`язок
запишемо Дану
внаслідок ізохоричного охолодження одного кіломоль ідеального газу в моль вимірюють кількість речовини позначається маленькою літерою префікс кіло означає 10³ Отже внаслідок ізохорного охолодження одного кіло моль ідеального газу тиск знизився у три рази Якщо тиск на початку позначити P1 а в кінці тобто після ізохоричного охолодження P2 тоді тиск P1 буде рівний трьом тиском Т2 Потім після закінчення ізохоричного охолодження ГАЗ розширився уже за постійного тиску необхідно побудувати графік процесу що відбувається в координатах PV тобто тиск об`єм а також знайти роботу а велике виконану газом в даному процесі якщо в кінцевому і початковому станах його температура дорівнює 300 кельвінів на початку температура
була рівна T1 потім в результаті ізохоричного охолодження
температура змінилася так як газ охолодився до температури Т2 а потім в результаті розширення за постійного тиску досяг температури Т3 яка рівна T1 і дорівнює 300 км
роботу газу в нашому процесі тобто спочатку в результаті ізохорного охолодження потім розширені за постійного тиску можна подати як суму робіт
під час ізохорного охолодження а1-2+ роботу під час розширення за постійного тиску а2,3
коли ми маємо справу з ізохоричним охолодженням ми маємо справу з ізохорним процесом тобто процесом змінювання стану даного газу деякої маси за незмінного об`єму у випадку ізохоричного процесу газ роботи не виконує тобто робота дорівнює нулю
таким чином
роботу виконану газом загальна робота виконана газом буде визначатися роботою яку він виконав під час розширення за постійного тиску а 2 3
процес який відбувається за постійного тиску називається ізобарним
і Робота під час ізобарного процесу коли п = Констант визначається по формулі А дорівнює P помножити на V2 - V1 різницю об`ємів від кінцевого стану відняти початковий в нашому випадку ми маємо справу з ділянкою не один два а два три тому що ділянка один два в нашому випадку ми мали ізохоричний процес на ділянці 2-3 наша робота буде розраховуватись по формулі
P2 помножити на V3 - V2
згідно умови задачі для того щоб розрахувати
роботу її числове значення нам необхідні числові значення параметрів від яких залежить робота А як ми бачимо числові значення нам відомі лише по відношенню до температури газу і абсолютно невідомі по відношенню до об`єму та тиску єдине що ми знаємо що на окремих ділянках процесу тиск був незмінним А на окремих незмінне було об`єм Тому нам краще для розрахунку роботи перейти від розрахунку на основі макроскопічних параметрів тиск об`єм до розрахунку на основі температури та кількості речовини тобто кількості нашого газу в молях для цього необхідно використати рівняння стану для будь-якого стану ідеального газу в тому числі для наших станів 1-2 і три ми можемо записати рівняння менделєєва-клапейрона ПВ = м маса газу поділити на м велике маса одного моля газу помножити на РТ відношення маси газу до маси одного моля дасть нам кількість моль і позначає яке позначається маленькою літерою U скористаємося рівнянням стану ідеального газу от в цьому вигляді для того щоб виразити роботу не через об`єм та тиск через температуру в цьому випадку робота на ділянці 2-3 тобто при розширенні за постійного тиску буде рівна New R виносимо за дужки помножити на різницю температур Т3 - Т2 в даній формулі у нас залишається невідомою температура Т2 для того щоб розрахувати роботу Нам необхідно встановити її значення для того щоб встановити значення температури Т2 на основі даних нашої задачі необхідно ще раз розглянути ізохорний процес на ділянці 1-2
на ділянці 1-2 ми мали справу з ізохорним процесом Відомо що ізохорний процес описується законом Шарля який говорить наступне для даного газу деякої маси відношення тиску
газу до його температури є незмінним якщо об`єм газу в не змінюється тобто V дорівнює констант іншими словами якщо ми маємо два стани газу які характеризуються
тиском P1 та температурою Т1 в стані 1 та тиском п2 та температурою Т2 в стані два то з даного
факту що ми маємо справу з ізохорним процесом ми можемо написати наступну рівність p1/1 = P2 поділити на Т2 з даної формули знаючи температуру Т1 ми можемо визначити цю температуру через значення температури Т2 і тиск P1 і Т2 або навпаки знаючи температуру Т2 можемо виразити температуру Т1 через
тиск P1 і 2 таким чином в нашому випадку з закону Шарля ми зможемо визначити температуру Т2 вона буде дорівнювати
Т1 помножити на п2 поділити на Р1
підставивши в дану формулу значення P1 яке виражається через P2 3 п2 отримаємо що температура газу після завершення ізохорного охолодження в стані 2 буде дорівнювати 1/3 температура T1 або підставивши значення 100 кельвінів таким чином
ми можемо зрештою розрахувати роботу нашого процесу
так як робота нашого процесу рівна роботі на ділянці при якій на якій газ розширявся за постійного тиску
ми можемо розрахувати її підставивши значення температур
так як ми вже говорили а дорівнює робота юн помножити на T3 - Т2 перевіряємо одиниці вимірювання кількість речовини вимірюється в моль R універсального газового стала в джоулях поділити на моль помножити на Кельвін і різниця температур це будуть кельвіни мінус Кельвін і не зрештою це будуть просто кельвіни скорочуються молій кельвіні залишається Джоулі тобто роботи вимірюється в джоулях що є правильним підставляємо числове значення кількість речовини кількість нашого газу 10/3 степені моль помножити на R універсальне газова стала 8,31 Дж поділити на моль помножити на Кельвін і помножити на різницю температур Т3 300 кельвінів мінус 100 кельвінів Т2 Провівши обчислення матимемо що робота буде Рівне 1,662 на 106 степені Джоуля або врахувавши що 10 в шостій степені можна замінити префіксом мега та заокругливши матимемо що робота буде наближено рівна 1,7 мдж нам залишається побудувати графік процесу що відбувся або що відбувається в координатах PV тиск об`єм
зазвичай при побудові графіків використовують конкретні числові значення які характеризують стани і інформацію про процес який відбувається між цими станами наприклад ізохоричний або ізобарний в нашому випадку у нас немає можливості визначити значення об`єму та тиску тому що для цього щоб визначити об`єм та тиск нам не вистачає даних все що ми можемо знати це температуру в
станах 1 2 3 нашого газу тому графік процесу який ми побудуємо в координатах PV він відображатиме не конкретні числові значення а загальну модель того що відбувалося Тобто ми нанесемо на осі значення P1 тиску для стану 1
нанесемо значення P2 тиск газу в стані 2 коли почалося ізобарное розширення
нанесемо об`єм V2 тобто об`єм який наш газ мав після ізохоричного охолодження а також Витри об`єм який наш газ набув після того як ізобарно розширився причому ми врахуємо що координати точки 1 тобто першого стану P1 V1 будуть співпадати з точкою P1 V2 тому що при ізохоричному охолодженні наш об`єм в станах 1,2 залишався однаковим Аналогічно в станах 2,3 при розширенні за постійного тиску у нас значення р3 і Р2 співпадало
Таким чином ми можемо нанести на в координати ПВ відповідні точки які характеризуватимуть стани а потім зобразити ізохору що відповідає ізохоричному охолодженню при якому залишається постійний об`єм але тиск Як ми знаємо ж умови зменшується втричі
ніж станами 2 і 3 ми маємо розширення тобто збільшення об`єму за постійного тиску стрілочкою вказано напрям процесу
Дана даний графік на ділянці 2-3 називається ізобарою
ча робота яку ми числове значення якої ми розрахували буде рівно площі фігури під
графіком що відповідає процесу 2-3 тобто під ізобарою в даному випадку ось цьому зафарбованому прямокутнику
задачу 4 користуючись графіком який наведено на рисунку знайдіть роботу яку виконує газ під час процесу
розв`язок
Отже користуючись графіком необхідно знайти роботу
яку виконує газ під час процесу процес який зображений на малюнку називається циклічним
циклічним називається Такий процес в якому початковий кінцевий стан газу збігається
тобто макроскопічні параметри В початковому кінцевому стані об`єм тиск і температура співпадають
робота повна яка буде виконана під час цього циклу один два два три та три один може бути подана Суми Суми Як сума робіт на кожній з ділянок тобто загальна робота а буде рівно на сумі робіт на ділянці а1-2 на ділянці 2-3 та на ділянці 3 1А 1 2 + а23 + A3 1 і Кожна з цих робіт може бути і повинно бути розрахована індивідуально до прикладу на ділянці а1-2 ми маємо випадок розширення газу тому що кінцевий об`єм в стані два більші за об`єм стані 1 за незмінного тиску P1 = Р2 Такий процес називається ізобарним
і під час даного процесу робота буде дорівнювати добутку тиску P на різницю об`ємів або якщо ми маємо справу з графіком залежності P від V вона буде рівна площі фігури
під графіком процесу
у випадку
якби би мали справу з стисненням тобто коли б газ переходив стан у два стан 1
при сталому тиску ми б отримали роботу яка теж обчислюється по аналогічній формулі і чисельно ця робота була рівна площі фігури під графіком P від V даного процесу але врахувавши те що кінцеві об`єм буде менший за значенням від початкового знак роботи відповідно буде від`ємний тому що різниця V2 V1 буде менше нуля Таким чином якщо оця стрілочка напрямлена в сторону з ліва направо тобто коли ми маємо справу з ізобарним стисненням робота буде від`ємна
при довільному процесі мається на увазі процеси де довільним чином змінюється температура тиск або газ
геометричний зміст роботи залишається таким же самим робота чисельно дорівнює площі фігури під графіком залежності P від V
тому в нашому випадку на ділянках 2 3 і 3 1 Ми теж можемо обрахувати площу а знаючи площу під цими ділянками ми відразу будемо знати числове значення
роботи причому робота буде як додатня яку випадку ділянки 1-2 так і від`ємна яку випадку ділянки 2.3 і 3.1 тому що на ділянках 2 3 і 3 1 на оцих під процесах загального циклічного процесу ми маємо справу з тим що кінцевий об`єм буде менше буде меншим за початковий і відповідно різниця об`ємів при розрахунки роботи дасть нам знак мінус іншими словами Якщо у нас площа на ділянці 1-2 зображено На малюнку це є робота а1-2 то на ділянці 31 та 2-3 наша робота буде рівна площа ось цих трапецій прямокутних
якщо ми подивимося на малюнок то для того щоб розрахувати загальну роботу в процесі 1 2 3 і з поверненням в стан 1 Нам необхідно від площі фігури на ділянці один два відняти площу фігур на ділянці 2-3 тому що вона буде від`ємна і робота буде від`ємна тому що робота буде від`ємна і на ділянці 3.1 де робота теж буде від`ємна
якщо ми це зробимо А розрахувати площу на ділянці 1-2 не важко це є прямокутник площа прямокутника - це добуток сторін Аналогічно ми знаємо як знаходити площу трапеції На минулому уроці ми саме цим і займалися в одній задачі
тому розрахувавши три площі і віднявши від площі а1-2 площі а2,3 та 31 Ми отримаємо значення роботи в циклічному процесі і це значення роботи буде більше нуля тому що площа прямокутника перевищує сумі площ оцих двох трапецій Це дуже добре видно з малюнка є тільки один нюанс нюанс полягає в тому що Провівши такі розрахунки розрахувавши площі трьох фігур прямокутника і двох трапеції хоча оці трапеції вони як ми бачимо з малюнка вони будуть однакові Тому нам достатньо розрахувати площу однієї трапеції помножити на 2 ми зрештою отримаємо площу числове значення якої буде Рівне площі Ось цього трикутника ось цю комірця
Таким чином ми отримаємо Іще один спосіб розрахунку роботи в даному циклічному процесі Тобто ми можемо розраховувати роботу шляхом безпосереднього розрахунку площі Ось цього як видно з малюнка рівнобедреного трикутника
розрахувавши площу цього трикутника а він з побудови видно що він рівнобедрений ось ці сторони однакові значить у Ці дві сторони однакові значить оце Основа рівнобедреного трикутника оце його бічні сторони а оце буде його висота він такий Перевернутий
перед тим як розраховувати площу даного трикутника яка чисельно дорівнює роботі в нашому циклічному процесі зробимо висновок з того що ми щойно сказали висновок наступний що робота в циклічному процесі дорівнює площі
контура яку обмежує графік цього процесу причому якщо обхід відбувається
за годинниковою стрілкою як у нас зображено на малюнку то ми матимемо справу з роботою яка буде більше нуля Якщо ж процес буде відбуватися проти годинникової стрілки 1 3 2 1 то ми аналогічним чином можемо провести розрахунки і дійти до того що робота в даному процесі циклічними які відбуваються проти годинникової стрілки буде менше нуля
Отже знайдемо площу нашого прямокутного трикутника
рівнобедреного трикутника точніше
рівнобедрений трикутник
складається з двох прямокутних трикутників причому однакових
Таким чином ми можемо з цих двох прямокутних трикутників якщо ми цей другий розвернемо на 180 градусів скласти ось такий Прямокутник з стороною H де H називається висота рівнобедреного трикутника та з іншою стороною яка буде рівна половині основи оця площа цього прямокутника буде рівна площі за числовим значенням у цього рівнобедреного трикутника а площу цього прямокутника обраховується Дуже просто Це буде H помножити на а поділити на 2 кажуть плюс площа рівнобедреного трикутника дорівнює півдобутку добутку висоти
на половину основи
в нашому випадку висота
нашого трикутника буде дорівнювати різниці тисків тобто P
1 -3
P1 -3 а основа яку ми поділимо на 2 буде рівна V2
-v1 таким чином робота в нашому циклічному процесі буде дорівнювати p1-3 помножити на V2 - v1/2 нам залишається зафіксувати значення p1p3 V2 і V1 це зробити буде не важко тому що на усяг у нас відкладені числові значення єдине що треба звернути увагу що по якій відкладено тиск ми маємо справу з кілопаскалями префікс кіло означає 10³ Отже р3 у нас буде дорівнювати то кілопаскаль або 100 на 10³
па-1 буде дорівнювати 200 кПа на 10/3 Паскаль В2 буде дорівнювати 4 метри кубічних а В1 буде дорівнювати один метр кубічний
після цього можемо підставити значення спочатку перевіряємо одиниці вимірювання 1/2 безрозмірна різниця об`ємів дасть нам метри кубічні мінус метри кубічні метри кубічні різниця тисків Паскалі дасть на паскалі Паскалі тиск розписується як відношення сили на площу тобто ньютони на метри квадратні в результаті метри квадратні скорочується Вона залишиться добуток ньютонів ньютонів на метри тобто сила на переміщення Що є одиницею вимірювання роботи джоулями рахуємо числове значення робота а = 1/2 помножити на V2 - V1 4 м³ - 1 м³ * 200 на 103 або два на 10 в п`ятому Паскаль мінус 10 в 5 степені Паскаль Провівши розрахунки матимемо що в даному випадку робота буде рівна
1,5 буде 3 поділити на 2 на 10.5 степені Джоуля або 150 кДж
домашнє завдання повторити параграф 37 вправа номер 37 пункти 3 та 5
Якщо вам сподобалось не забудьте про лайк підписку та поширте відео серед тих кому воно теж може бути цікавим дякуємо за увагу
