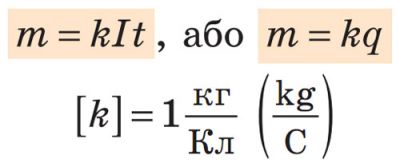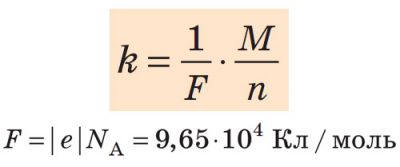Електричний струм в електролітах. Електроліз
 11 клас
11 клас Мета онлайн уроку: формувати під час очного або дистанційного навчання уявлення про природу електричного струму в розчинах і розплавах електролітів та процесу електролізу; з’ясувати фізичний зміст законів електролізу Фарадея та поняття електрохімічного еквівалента; ознайомити учнів з практичним застосуванням електролізу
Т. Фуллер
Актуалізація опорних знань. Перевірка знань
Як пам’ятаєте (з уроків фізики 8 класу), електроліз дуже поширений в сучасній техніці. Завдяки йому заряджають акумулятори, очищаються воду та метали, добувають водень, роблять копії деталей, покривають одні метали іншими, а також, гравірують. Давайте подивимося на останнє, перед початком теми, щоб пригадати, на що здатен електроліз на практиці. Адже його можливості фантастичні.


Вивчення нового матеріалу «Електричний струм в електролітах. Електроліз»
Опрацьовуємо очно або дистанційно параграф «Електричний струм в електролітах. Електроліз» §6 за підручником «Фізика 11 клас, В. Г. Бар’яхтар, С. О. Довгий». Пишемо конспект.
Для візуалізації фізичних явищ можна скористатися анімаціями/симуляціями за вказаними посиланнями: дисоціація, електроліз, свинцево-кислотний акумулятор.
Розпочинаємо з узагальнюючого відео по темі.


Електричний струм в електролітах
Електроліти — тверді або рідкі речовини, які мають йонну провідність.
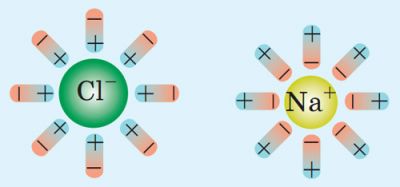
Електролітична дисоціація (від латин. dissociatio — розділення) — це розпад речовин на йони внаслідок дії полярних молекул розчинника.
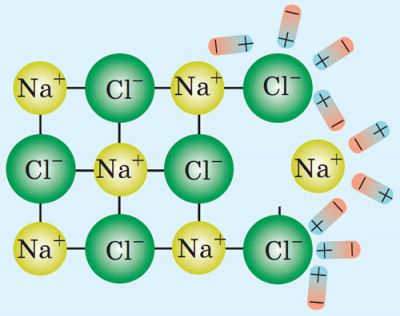
Наприклад, коли кристалик кухонної солі потрапляє у воду, полярні молекули води оточують йони Натрію та йони Хлору і відокремлюють їх від кристалика.
У результаті в розчині з’являються вільні заряджені частинки — позитивні й негативні йони.
Електричний струм у розчинах і розплавах електролітів являє собою напрямлений рух вільних йонів.
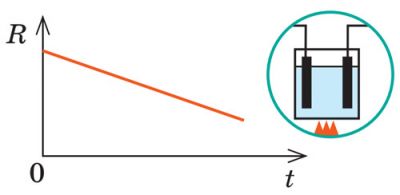
Зі збільшенням температури кількість йонів в електроліті значно збільшується, тому, опір електроліту зменшується.
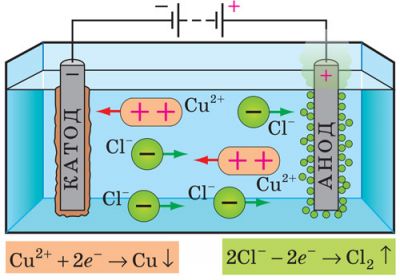
Електроліз
Процес виділення речовин на електродах, пов’язаний з окисно-відновними реакціями, які відбуваються на електродах під час проходження струму, називають електролізом.
Закони М. Фарадея для електролізу
Англійський фізик Майкл Фарадей (1791-1867 рр)
Перший закон електролізу
Маса речовини, яка виділяється на електроді під час електролізу, прямо пропорційна силі струму I та часу t його проходження через електроліт:
Другий закон електролізу
Електрохімічний еквівалент k прямо пропорційний відношенню молярної маси М елемента до валентності n цього елемента в даній хімічній сполуці:
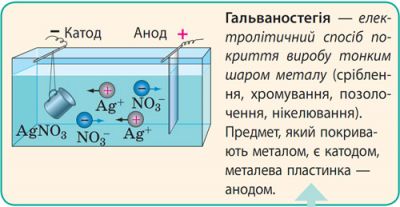
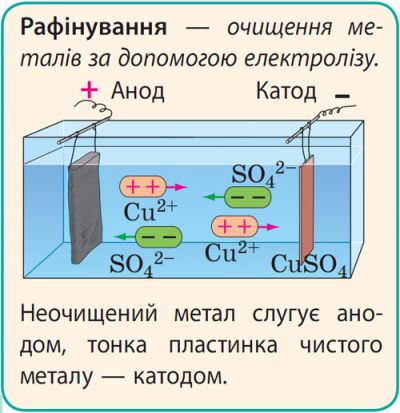
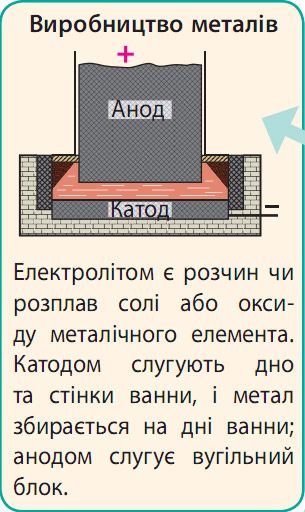
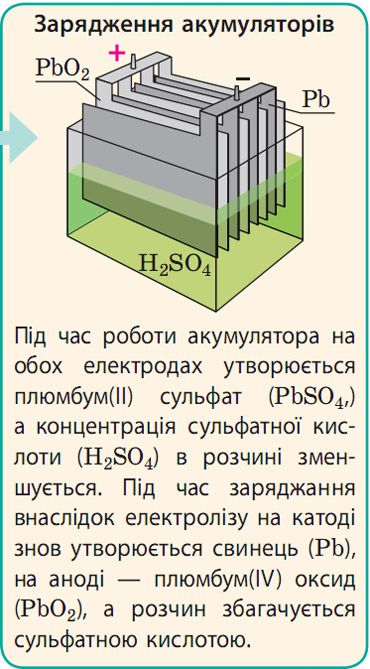
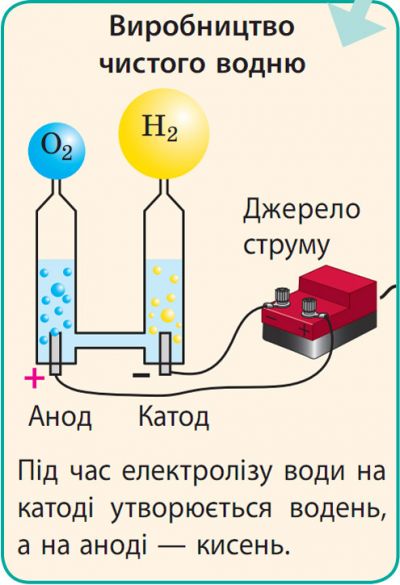
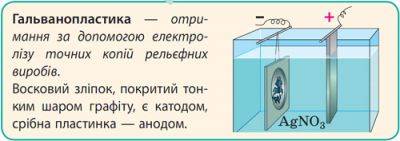
Застосування електролізу
Закріплення набутих знань
Пройдемо інтерактивний тест онлайн уроку «Електричний струм в електролітах. Електроліз», побудований на основі контрольних запитань параграфа, для остаточного закріплення поданого матеріалу.
Тест "Електричний струм в електролітах. Електроліз"
Розглянемо задачу з п. 5 «Учимося розв’язувати задачі» з підручника на сторінці 31 та проаналізуємо розв’язок.
Домашнє завдання
Вправи до онлайн уроку «Електричний струм в електролітах. Електроліз», які вкаже ваш учитель фізики.
Наприклад, Вправа 6, завдання 2 за підручником «Фізика 11 клас, В. Г. Бар’яхтар, С. О. Довгий». Значення електрохімічного еквівалента, який потрібен для задачі, беремо на сторінці 260. Також законспектуйте задачу з п. 5 «Учимося розв’язувати задачі», яку розглянули під час вивчення теми.